MORBUS KRABBE
Descrizione
La forma infantile esordisce a 2-6 mesi e ha 3 stadi. Nel I stadio, i sintomi sono irritabilità, rigidità, scarso controllo del capo, difficoltà nell'alimentazione, flessione intermittente del pollice, aumento intermittente della temperatura, e ritardo dello sviluppo. Nel II, compaiono episodi di ipertono con opistotono, crisi miocloniche, regressione dello sviluppo, deficit visivo e difficoltà nella chiusura a pugno della mano. Nel III, insorgono ipotonia, cecità e sordità. La malattia esita in stato vegetativo e decesso prima dei 2-3 anni, di solito a causa di infezioni respiratorie. Nelle forme tardo-infantili/giovanili (1-8 anni) e dell'adulto (>8 anni), i sintomi di esordio sono molto diversificati, la progressione è variabile (in genere più lenta nei più anziani). I quadri clinici della forma tardo-infantile/giovanile sono più simili a quelli della forma infantile, mentre i primi segni nelle forme dell'adulto sono spesso debolezza, andatura anomala (paraparesi spastica o atassia), parestesie brucianti, emiplegia, e/o perdita della vista, con o senza neuropatia periferica. È variabile la regressione cognitiva, spesso assente nelle forme dell'adulto.
Dati eziologici
È dovuta a mutazioni nel gene GALC (14q31), che codifica per l'enzima lisosomiale galattocerebrosidasi, che catabolizza l'idrolisi del galattosio dai galattocerebrosidi e dalla galattosilsfingosina (psicosina). L'accumulo di psicosina citotossica provoca l'apoptosi degli oligodendrociti e la demielinizzazione del SNC e SNP. Di rado, la forma infantile è dovuta a mutazione nel gene della prosaposina (PSAP; 10q21-q22), che codifica per la proteina saposina-A attivatrice degli sfingolipidi, necessaria per l'attività di GALC.
Metodi diagnostici
La diagnosi si basa sul quadro clinico, sulla diminuzione della velocità di conduzione nervosa, sulle anomalie all'elettroencefalogramma, e sulle anomalie della sostanza bianca alla risonanza magnetica cerebrale (demielinizzazione, gliosi, atrofia cerebrale in fase avanzata, calcificazioni cerebrali). La diagnosi è stabilita con saggi enzimatici su leucociti o fibroblasti in coltura, che rivelano quasi sempre un deficit di GALC. L'istologia mostra cellule globoidi tipiche (spesso cellule multinucleate derivate da macrofagi con galattocerebroside non idrolizzato) nella sostanza bianca. Le analisi molecolari confermano la diagnosi.
Diagnosi differenziale
La diagnosi differenziale si pone con la leucodistrofia metacromatica, la gangliosidosi GM1 e GM2, l'encefalopatia da deficit di prosaposina, l'adrenoleucodistrofia legata all'X, la malattia di Pelizaeus-Merzbacher, Alexander e Canavan.
Diagnosi prenatale
Nelle famiglie a rischio, è possibile la diagnosi prenatale (saggio enzimatico o analisi di mutazione). Se sono note mutazioni malattia nella famiglia, è possibile la diagnosi genetica preimpianto.
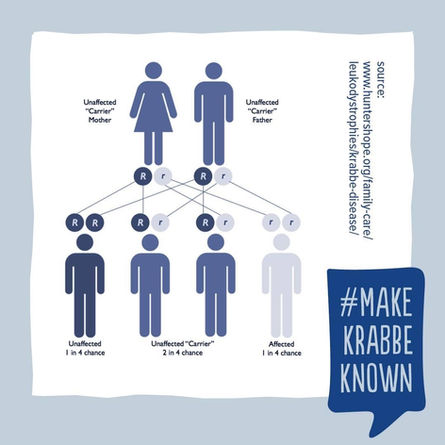
Consulenza genetica
La trasmissione è autosomica recessiva. La consulenza genetica dovrebbe essere offerta alle coppie a rischio (entrambi i genitori portatori sani della mutazione patogenetica), comunicando il rischio di occorrenza/ricorrenza del 25%.
Presa in carico e trattamento
Nei pazienti pediatrici presintomatici e con forme meno gravi a esordio tardivo, il trattamento si limita al trapianto di cellule staminali ematopoietiche, che è in grado di rallentare la progressione. Sono in fase di studio nei modelli animali altre opzioni terapeutiche (terapia enzimatica sostitutiva, genica e con chaperonine).
Prognosi
L'esordio più precoce si associa a neurodegenerazione e morte prematura (<2-3 anni), quello tardo-infantile/giovanile a decesso in genere entro i 2-7 anni dalla comparsa dei sintomi. Nella forma dell'adulto, i pazienti sopravvivono molti anni dopo l'esordio.